Quali sono i contributori della risonanza maggiore e minore per l'anione azide, # N_3 ^ - #?
I passaggi per disegnare le strutture di Lewis sono:
1. Scrivi tutte le possibili connessioni per gli atomi di azoto.
NNN
2. calcolato#V#, il numero di elettroni di valenza hai effettivamente disponibile.
#V# = 3 N +1 = 3 × 5 + 1 = 16.
3. calcolato #P#, il numero di elettroni π che ci devono essere nella molecola:
#P = 6n + 2 – V#
where #n# è il numero di atomi non di idrogeno nella molecola.
#P# = 6 × 3 + 2 - 16 = 4 π elettroni. Quindi ci sono due doppi legami o un triplo legame.
4. Disegna nuove strutture.
Questa volta inserire i doppi e tripli legami in tutte le possibili combinazioni.
5. Aggiungi elettroni di valenza per dare ad ogni atomo un ottetto.
6. Calcola la carica formale su ciascun atomo.
Finiamo con 3 possibilità.
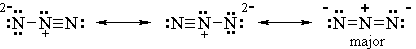
7. Identifica il collaboratore principale.
Tutte e tre le strutture hanno una separazione di carica.
Le prime due strutture hanno una carica di 2- su un atomo N. La terza struttura ha una carica di -1 su due atomi di N separati.
Il collaboratore più stabile avrà la massima delocalizzazione o diffusione a titolo gratuito.
Quindi le prime due strutture contribuiscono in modo minore e la terza è il principale.

