Come posso determinare l'ibridazione e il legame nell'ammoniaca?
Risposta:
Ecco come farlo.
Spiegazione:
Disegna la struttura di Lewis (passaggio 1) e la usi VSEPR teoria per determinare la sua geometria del dominio di elettroni come tetraedrica e la sua forma molecolare (Fase 2) come una piramide trigonale.
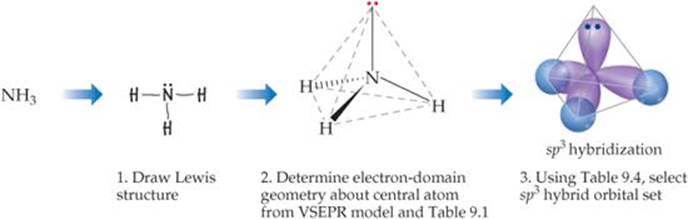
Quindi consulta una tabella come quella qui sotto.

(Adattato da SlideShare)
Trovi che il #"N"# usi dell'atomo #"sp"^3# orbitali, in modo da disegnare quattro forme a goccia che puntano verso gli angoli di un tetraedro (Passaggio 3).
The #"H"# gli atomi usano il loro #"1s"# orbitali per bonding, quindi disegni piccoli cerchi che si intersecano con tre dei #"sp"#3 orbitali.
Ciò dimostra che il #"N-H"# le obbligazioni sono obbligazioni σ formate dalla sovrapposizione di #"sp"^3# orbitali di #"N"# e #"1s"# orbitali di #"H"#.
Tuttavia, gli orbitali molecolari includono entrambi #"N"# e #"H"# nuclei.

Nel diagramma sopra, il disegno della linea di legame mostra che #"H"# i nuclei sono completamente all'interno del più grande a forma di lacrima #"sp"^3"-s"# σ orbitali molecolari.

