Come troveresti il numero atomico, la massa atomica, i protoni, i neutroni e gli elettroni per ioni e isotopi? È simile?
Risposta:
Utilizzare la tavola periodica per ottenere le informazioni richieste.
Spiegazione:
Il simbolo per un isotopo di un elemento come #"O"# è spesso scritto come #""_8^16"O"^n#.
-
The #"O"# è, ovviamente, il simbolo di un atomo di ossigeno.
-
Il pedice rappresenta il numero atomico #Z#, il numero di protoni nel nucleo.
-
L'apice in alto a sinistra rappresenta il numero di Massa #A#, il numero totale di protoni e neutroni nel nucleo.
-
L'apice in alto a destra rappresenta la carica sullo ione (ad es. +1 o -2).
-
Se non c'è nessun apice in alto a destra, la carica è zero e abbiamo un atomo neutro.
Quanti protoni, neutroni ed elettroni ci sono in un atomo di mercurio-201?
Innanzitutto, devi trovare l'elemento in Periodic Table.
Tutte le tabelle periodiche forniscono almeno il simbolo e il numero atomico dell'elemento.
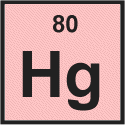
Vediamo che per il mercurio il il numero atomico è 80.
Il numero atomico è il numero di protoni nel nucleo di un atomo, quindi possiamo dire subito che un atomo di mercurio contiene 80 protoni.
Il numero di massa (201) è il numero totale di protoni e neutroni.
Quindi, ci devono essere 201 - 80 = 121 neutroni.
Poiché gli atomi sono elettricamente neutri, devono esserci tanti elettroni quanti sono i protoni.
Un atomo di mercurio ha bisogno 80 elettroni per bilanciare gli 80 protoni.
In sintesi:
- Numero di protoni = numero atomico #Z#
- Numero di elettroni = numero atomico #Z#
- Numero di neutroni = numero di massa - numero atomico = #A – Z#
Quanti protoni, neutroni ed elettroni ci sono dentro #""_80^200"Hg"^(2+)#?
Qui abbiamo 80 protoni e 200 - 80 = 120 neutroni.
La carica "2+" ci dice che abbiamo perso due elettroni.
Quindi ci sono 80 - 2 = 78 elettroni.
Pertanto, il processo è simile sia per gli isotopi che per gli ioni.

