In che modo le strutture di risonanza influenzano l'acidità?
Risposta:
Risposta breve: risonanza le strutture che stabilizzano una base coniugata aumenteranno l'acidità.
Spiegazione:
Considera le acidità del metanolo e dell'acido acetico.
CH₃OH + H₂O ⇌ CH₃O⁻ + H₃O⁺; #pK_"a"# = 15
CH₃COOH + H₂O ⇌ CH₃COO⁻ + H₃O⁺; #pK_"a"# = 5
Perché è l'acido acetico #10^10# volte acido quanto il metanolo?
Risposta: Ecco la mia spiegazione.
Nello ione metossido, la carica negativa è localizzata (concentrata) sull'atomo di ossigeno.
La risonanza stabilizza sia l'acido acetico che lo ione acetato,
Nell'acido acetico, la stabilizzazione è piccola perché il contributo di risonanza comporta la separazione della carica.
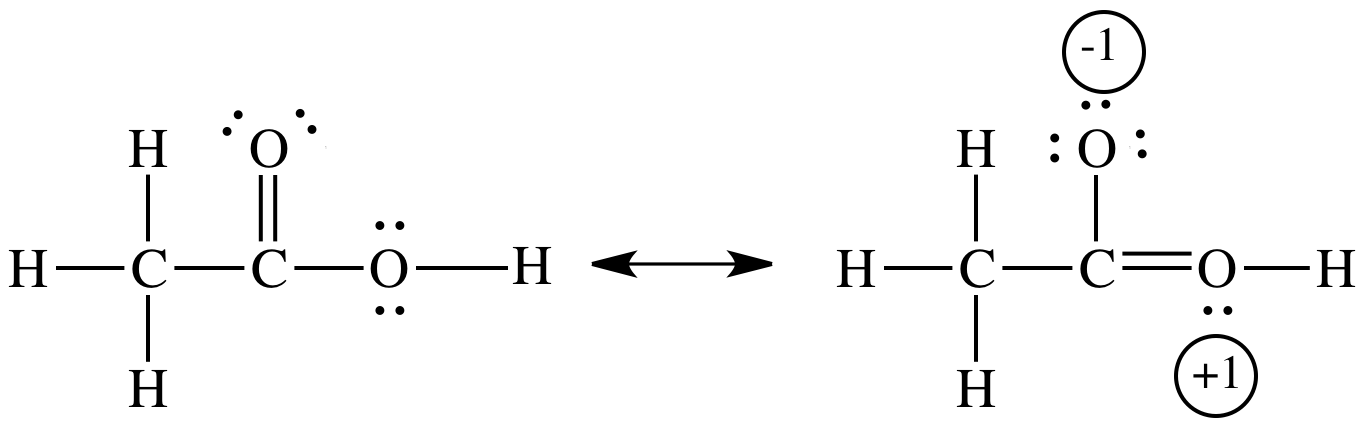
Nello ione acetato non esiste separazione della carica.
Invece, la carica negativa è delocalizzata (distribuita) su tre atomi. Questa delocalizzazione produce uno stato di energia inferiore.
Se i prodotti di una reazione sono più stabili dei reagenti, la posizione di equilibrio si troverà a destra.
Quindi, la stabilizzazione della risonanza dello ione acetato rende l'acido acetico più acido del metanolo.
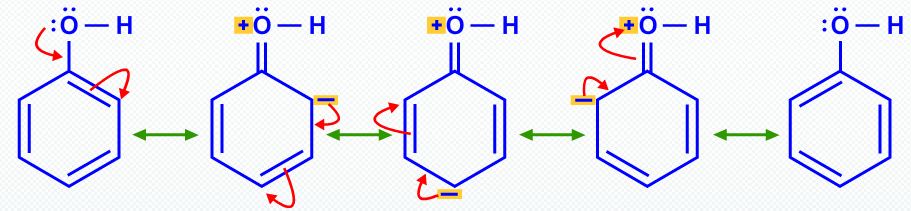
Allo stesso modo, la risonanza rende il fenolo più acido dell'etanolo.
Non c'è stabilizzazione di risonanza nello ione etossido.
#"CH"_3"CH"_2"OH" + "H"_2"O" ⇌ "CH"_3"CH"_2"O"^"-" + "H"_3"O"^"+"; "p"K_text(a) = 17#
La risonanza stabilizza lo ione fenolo e fenossido mediante delocalizzazione di elettroni nell'anello.
Tuttavia, questa localizzazione nel fenolo comporta la separazione della carica e rende positivo l'atomo di ossigeno.
La stessa delocalizzazione in ione fenossido fornisce molta più stabilizzazione perché non vi è alcuna separazione di carica.

La posizione di equilibrio si trova a destra. #"p"K_text(a) = 10#.
Quindi, il fenolo è #10^7# volte acido quanto l'etanolo perché la risonanza stabilizza lo ione fenossido.