Quali sono considerati i gruppi di partenza "buoni"?
Risposta:
Buone lasciando i gruppi sono basi deboli.
Spiegazione:
Considera una reazione di sostituzione nucleofila generale.
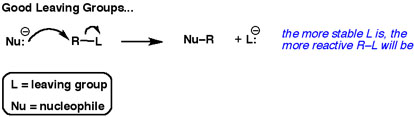
La seconda freccia mostra sempre una coppia di elettroni in movimento verso il gruppo uscente.
I migliori gruppi uscenti "vogliono" quegli elettroni. Non vogliono condividerli con altri atomi.
I buoni gruppi di partenza sono basi deboli.
Le basi deboli hanno acidi coniugati forti. Quindi possiamo identificare le basi deboli guardando a #"p"K_"a"# tabella.
Attenzione: Il #"p"K_"a"# il valore misura la posizione di un equilibrio. Ma lasciare l'abilità di gruppo si basa sui tassi di reazione. Quindi, sebbene la correlazione sia buona, non è perfetta.

In generale, più debole è la base, migliore è il gruppo uscente.
Eccezione: Il fluoro è un gruppo uscente povero.
F è un piccolo ione. La sua elevata densità di carica lo rende relativamente non polarizzato. Il gruppo uscente deve essere polarizzabile per ridurre l'energia dello stato di transizione. Non dovresti mai vedere F⁻ partire in un #"S"_"N"2# reazione.
Domanda: Perché l'acqua è un buon gruppo uscente?
Risposta#color(white)(ll)#: Non lo è! Lo ione idronio è il gruppo uscente.
Spiegazione:
Considera l'equilibrio
#"R-OH ⇌ R"^"+" + underbrace("OH"^"-")_color(red)("conj. base of H"_2"O")#
L'acqua è un acido debole, quindi lo ione idrossido è a base forte. "Vuole" usare gli elettroni della sua coppia solitaria per formare un legame covalente.
Pertanto, la posizione di equilibrio si trova molto a sinistra.
Se protoniamo l'alcool, otteniamo
#"R-"stackrelcolor(blue)(+)("O")"H"_2 ⇌ "R"^"+" + underbrace("OH"_2)_color(red)("conj. base of H"_3"O"^"+")#
L'acqua è la base coniugata dello ione idronio, l'acido più forte che può esistere nell'acqua, quindi l'acqua è una base debole.
Ha poca tendenza a condividere le sue coppie di elettroni con un'altra specie.
Acqua sotto forma di ione idronio è un eccellente gruppo uscente.
Ecco un video su ciò che rende un buon gruppo uscente.

