Come conosci gli orbitali ibridi di un composto? Ad esempio, quali sono gli orbitali ibridi di # CH_2Cl_2 #, # C_2H_4 # e # C_2H_2 #?
Risposta:
Gli orbitali ibridi dentro #"CH"_2"Cl"_2, "C"_2"H"_4# e #"C"_2"H"_2# impianti completi per la produzione di prodotti da forno #"sp"^3, "sp"^2^# e #"sp"#, Rispettivamente.
Spiegazione:
In ogni caso, è necessario disegnare la struttura di Lewis, determinare la geometria VSEPR e quindi assegnare l'ibridazione corrispondente.
#"CH"_2"Cl"_2#:
La struttura di Lewis di #"CH"_2"Cl"_2# is

Ci sono quattro domini di elettroni attorno all'atomo di carbonio, come fa la geometria elettronica tetrahedral.

L'ibridazione che corrisponde a una geometria tetraedrica è #"sp"^3#.

#"C"_2"H"_4#:
La struttura di Lewis di #"C"_2"H"_4# is
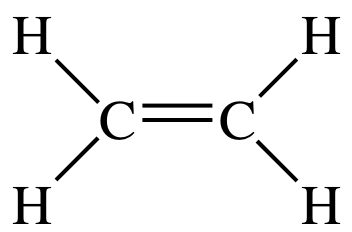
Ci sono tre domini di elettroni attorno a ciascun atomo di carbonio, quindi la geometria dell'elettrone è trigonale planare.
L'ibridazione che corrisponde a una geometria planare trigonale è #"sp"^2#.

#bb"sp"#
La struttura di Lewis di #"C"_2"H"_2# is

Ci sono due domini di elettroni attorno a ciascun atomo di carbonio, quindi la geometria dell'elettrone è lineare.

L'ibridazione che corrisponde a una geometria planare trigonale è #"sp"#.

(Da Learnnext)

