Come posso classificare ogni specie come acido Lewis o base Lewis per # BeCl_2 #, #OH ^ - #, #B (OH) _3 # e #CN ^ - #?
Disegna le loro strutture di Lewis e poi prendi una decisione in base a possibili reazioni.
Una sostanza può essere un acido di Lewis o una base di Lewis, a seconda della reazione. Ma spesso puoi fare una buona previsione.
BeCl₂
La struttura di Lewis per BeCl₂ è

Vediamo che l'atomo di Be ha solo quattro elettroni nel suo guscio di valenza. Be has an ottetto incompleto.
L'atomo Be accetterà gli elettroni per completare il suo ottetto.

Quindi BeCl₂ è un acido di Lewis.
OH⁻
La struttura di Lewis di OH⁻ è

L'atomo O ha tre coppie di elettroni solitari. Può donare questi elettroni per formare un legame con un altro atomo.

OH⁻ è una base di Lewis.
B (OH) ₃
La struttura di Lewis di B (OH) ₃ è

L'atomo B ha un ottetto incompleto, quindi può agire come un acido di Lewis.
HO⁻ + B (OH) ₃ → [HO-B (OH) ₃] ⁻
B (OH) ₃ è anche un ossiacido. Quindi l'atomo H può anche agire da acido di Lewis.
HO⁻ + HOB (OH) ₂ → H₂O + ⁻OB (OH) ₂
Comunque lo guardi, B (OH) ₃ è un acido di Lewis.
CN⁻
La struttura di Lewis di CN⁻ è
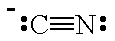
L'atomo C ha sia una coppia solitaria che una carica negativa, quindi si comporterà come una base di Lewis.
N≡C: ⁻ + CH₃-Br → N≡C-CH₃ + Br⁻
Ecco un video su come identificare gli acidi e le basi di Lewis.

