# BeCl_2 # e # TeCl_2 # sono entrambe molecole covalenti, tuttavia # BeCl_2 # è lineare mentre # TeCl_2 # è piegato. Perché?
#"TeCl"_2#: Il centrale #"Te"# atomo ha #6# elettroni di valenza. Quando i due #"Cl"# gli atomi si legano all'atomo centrale, ciascuno contribuisce con un elettrone a formare due legami sigma. Questo lascia #4# elettroni sugli atomi centrali sotto forma di #2# coppie di elettroni solitari.
Questa è la VSEPR forma #"AX"_2"E"_2#, una forma di tetraedro con due coppie di elettroni e due atomi, creando una forma molecolare piegata.
![]()
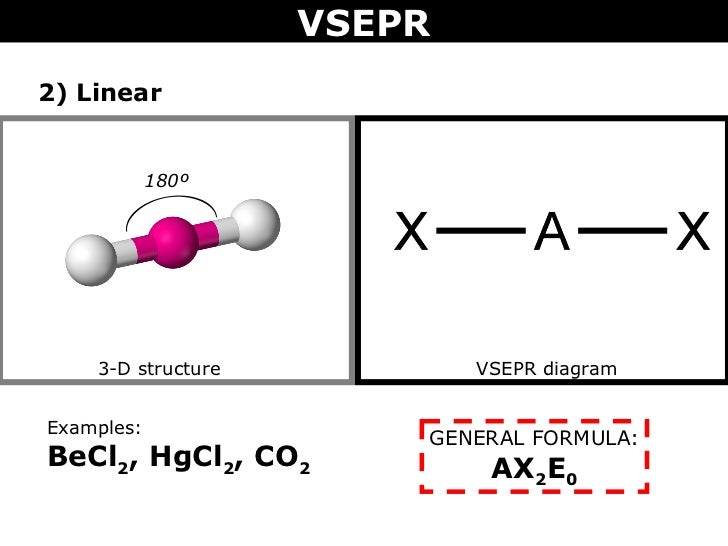
#"BeCl"_2#, d'altra parte, ha #"Be"# come il suo atomo centrale. Da #"Be"# ha solo #2# elettroni di valenza, i due legami sigma formati dal #"Cl"# gli atomi se ne vanno #"Be"# senza coppie solitarie.
La forma VSEPR è #"AX"_2"E"_0# e forma una forma lineare.