Come posso determinare se e quando una molecola ha o ha bisogno di una struttura di risonanza?
Risposta:
Una molecola può avere strutture di risonanza quando ha una coppia solitaria o un doppio legame sull'atomo accanto a un doppio legame.
Spiegazione:
Ogni volta che puoi disegnare due o più strutture di Lewis per una molecola, differendo solo nelle posizioni degli elettroni, la struttura effettiva non è nessuna delle strutture ma è una risonanza ibrido di tutti.
Ad esempio, qual è la struttura di Lewis dello ione nitrito, NO₂⁻?
1. Decidi qual è l'atomo centrale nella struttura. Normalmente sarà l'atomo meno elettronegativo (N).
2. Disegna una struttura scheletrica in cui gli altri atomi sono legati in modo singolo all'atomo centrale: ONO.
3. Disegna una struttura di prova mettendo coppie di elettroni attorno ad ogni atomo fino a quando ognuno non ottiene un ottetto. In questo editor, dovrò scriverlo come :: Ö-N (::) - Ö ::
4. Conta il elettroni di valenza nella struttura di prova (20).
5. Ora conta il elettroni di valenza hai effettivamente disponibile.
1 N + 2 O + 1 = 1 × 7 + 2 × 6 +1 = 18.
La struttura di prova ha due elettroni in più di quelli disponibili.
6. Disegna una nuova struttura di prova, questa volta inserendo un doppio legame per ogni coppia extra di elettroni: ON = O e O = NO (due possibilità) - Proprio qui, le due possibilità ci dicono che avremo due strutture di risonanza.
7. Come prima, aggiungi elettroni di valenza per dare ad ogni atomo un ottetto:
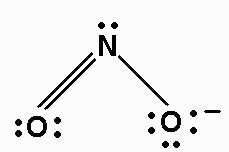
8. Assegna cariche formali a ciascun atomo.
Ogni atomo "possiede" i suoi elettroni a coppia solitaria e la metà delle coppie condivise.
L'atomo O destro ha 6 elettroni a coppia solitaria più 1 dal legame singolo. Questo è un elettrone in più rispetto a un atomo O isolato. Quindi l'accusa formale su O è -1.
Le due strutture di risonanza sono:

La struttura attuale non è nessuna di queste. È un ibrido di risonanza di entrambi.


