Come si disegnano le celle galvaniche?
Disegna l'anodo, il catodo, gli agenti ossidanti e riducenti, una piastra porosa o un ponte salino. Mostra la direzione del flusso di elettroni nel circuito esterno e il flusso di ioni nel circuito interno.
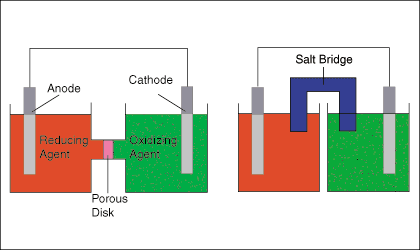
ESEMPIO:
Disegna un diagramma cellulare per la reazione
Zn (s) + Cu²⁺ (aq) → Zn²⁺ (aq) + Cu (s)
Soluzione:
A. Disegna uno dei diagrammi sopra (nessuna etichetta).
B. Identificare ciò che è ossidato e ridotto.
Zn è ossidato; Cu²⁺ è ridotto.
C. Inserire i materiali di ossidazione nella cella sinistra. Etichetta lo Zn come anodo negativo. Nella soluzione mettere Zn²⁺ e NO₃⁻.
D. Collocare i materiali di semi-reazione di riduzione nella cella di destra. Etichettare il Cu come catodo positivo. Nella soluzione inserire Cu²⁺ e SO₄²⁻ o NO₃⁻.
E. Metti un sale come KNO₃ nel ponte del sale.
F. Utilizzare le frecce per mostrare il flusso di elettroni nel filo esterno.

G. Mostra il flusso di ioni nel circuito interno.
I cationi - Zn²⁺, Na⁺ e Cu²⁺ - si spostano da sinistra a destra. Gli anioni NO₃⁻ si spostano da destra a sinistra. Disegna le frecce per mostrare questi movimenti.

