In che modo gli acidi e le basi di Lewis differiscono dagli acidi e dalle basi di Bronsted / Lowry?
Risposta:
Gli acidi e le basi di Lewis sono definiti in termini di capacità di accettare o donare coppie di elettroni. Mentre gli acidi e le basi di Bronsted Lowry sono definiti in termini di capacità di accettare o donare ioni idrogeno (#H^(+)#).
Spiegazione:
• Un acido Brønsted-Lowry è qualsiasi sostanza (molecola o ione) che può donare uno ione idrogeno (#H^(+)#).
• Una base di Brønsted-Lowry è qualsiasi specie che può accettare uno ione idrogeno (#H^(+)#).
#color(blue) ("Take the reaction below for example:")#
#HNO_2+ H_2O rightleftharpoons H_3O^(+) + NO_2^(-)#
Acido nitroso (#HNO_2#) è l'acido Brønsted-Lowry perché dona uno ione idrogeno all'acqua. L'acqua è la base di Brønsted-Lowry perché accetta lo ione idrogeno.
#color(red)("On the other hand")#, Gli acidi e le basi di Lewis sono definiti in termini di essere un donatore di una coppia di elettroni o un accettore di una coppia di elettroni.
• Un acido di Lewis è definito come un accettore di coppie di elettroni. Ciò significa che gli acidi possono accettare una sola coppia di elettroni da una base di Lewis perché l'acido ha orbitali di valenza vacanti.
• Un acido di Lewis deve avere un orbitale di valenza vuoto e può essere un catione, come ad esempio #Al^(3+)#o una molecola neutra, come #CO_2#.
• Una base di Lewis è un donatore di coppie di elettroni. Ciò significa che una base di Lewis ha la capacità di donare due dei suoi elettroni a un acido di Lewis.
Ecco una rappresentazione generale di una reazione acido-base di Lewis:
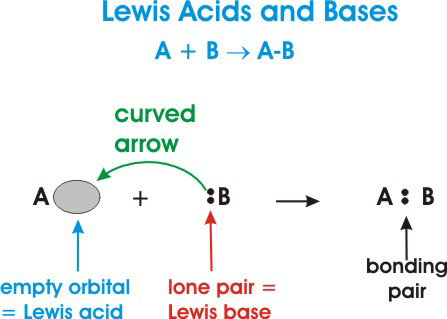
Nel diagramma sopra, #A# è un acido di Lewis perché accetta una coppia di elettroni da #B# come indicato dalla freccia curva.
#B# è una base di Lewis a cui sta donando i suoi elettroni #A#.

