In che modo i legami pi e sigma sono correlati all'ibridazione?
Risposta:
La maggior parte degli atomi ibrida i loro orbitali atomici s e p per ottenere gli orbitali molecolari più stabili.
Spiegazione:
Un guscio di valenza di un atomo ha un suo orbitale e tre orbitali p.
Quando due orbitali si sovrappongono, formano un legame σ.
Quando due orbitali p si sovrappongono da un lato all'altro, formano un legame π.

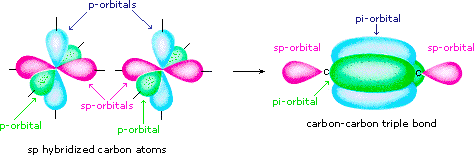
Gli orbitali s e p possono formare diverse ibridazioni.
s + p → sp
s + p + p → sp²
s + p + p + p → sp³
Quando due orbitali ibridi si sovrappongono, formano un legame σ.
Gli atomi ibridi sp³ usano tutti e tre gli orbitali p per l'ibridazione. Ciò significa che gli atomi ibridi sp³ possono formarsi solo legami sigma. Non possono formare più legami.
Gli atomi ibridi sp² usano solo due orbitali p nell'ibridazione. C'è un orbitale inutilizzato. Questo orbitale rimasto può creare un legame π con un altro atomo e creare un doppio legame.

Gli atomi sp-ibridati usano solo un orbitale nell'ibridazione. Ciò significa che è possibile creare due obbligazioni π.