In che modo l'ibridazione si collega alla geometria molecolare?
I chimici usano l'ibridazione per spiegare geometria molecolare.
VSEPR La teoria prevede la geometria e i chimici usano l'ibridazione per spiegarla.
Dicevano:
lineare → sp
trigonale planare → sp²
tetraedrico → sp³
trigonale piramidale → sp³d
ottaedrico → sp³d²
Ma l'ibridazione funziona solo per elementi nel secondo periodo di la tavola periodicae migliore per il carbonio.
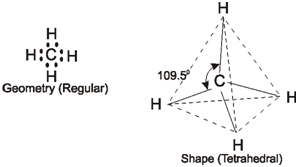
In CH₄, l'angolo di legame è di 109.5 °. Questo è l'angolo di legame sp³.
In H₂O, l'angolo di legame è 104.45 °.
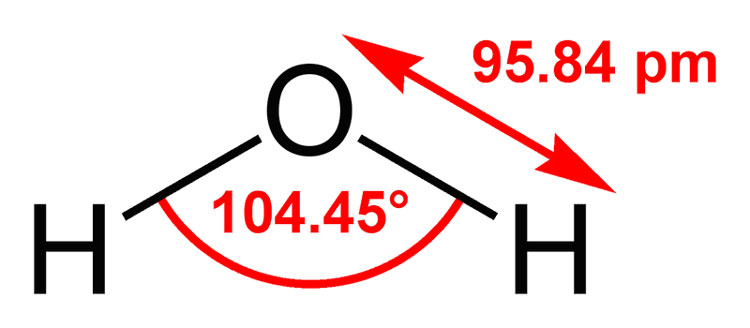
Questo è "vicino" all'angolo di legame sp³ di 109.5 °.
Per gli elementi dal 3 ° in su, gli angoli di legame sono ancora più lontani da quelli previsti dagli orbitali ibridi,

In H₂S, l'angolo di legame è di 92.1 °. Questo è molto più vicino a 90 ° che a 109.5 °. Suggerisce che S usa orbitali p non ibridati per formare i legami SH.
I chimici ora credono che gli orbitali d non siano coinvolti nelle geometrie trigonali bipiramidali e ottaedriche. Quindi non c'è ibridazione sp³d o sp³d².
Credono che PF₅ non espanda il suo ottetto. Invece, la molecola è a risonanza ibrido di cinque strutture di Lewis.

Due strutture hanno legami ionici nelle posizioni assiali e tre hanno legami ionici nelle posizioni assiali.
SF₆ è un ibrido di risonanza di strutture che hanno quattro legami covalenti e due ionici.

Ci sono 12 strutture con i due legami ionici adiacenti (cis) posizioni come mostrato, più 3 strutture con i due legami ionici opposti (trans) posizioni. Questo rende un totale di 15 collaboratori.

