Perché il calore dell'idrogenazione del benzene è inferiore alle aspettative?
Risposta:
Il calore dell'idrogenazione è inferiore al previsto perché il benzene è stabilizzato da risonanza.
Spiegazione:
Calori di idrogenazione
Il cicloesene ha un doppio legame e il suo calore di idrogenazione è -120 kJ / mol.
Il benzene ha tre doppi legami, quindi potremmo aspettarci che il suo calore di idrogenazione sia -360 kJ / mol.

Tuttavia, il suo calore misurato di idrogenazione è solo -208 kJ / mol.
Il benzene è più stabile del previsto di 152 kJ / mol. Questa differenza si chiama sua energia di risonanza.
risonanza

Possiamo scrivere due strutture di Lewis per il benzene, differendo solo nelle posizioni degli elettroni.
Ogni volta che possiamo farlo, la struttura corretta non è nessuna delle due. È un ibrido di risonanza di entrambi.
Tale struttura è più stabile di uno dei due collaboratori e la stabilizzazione aggiuntiva è chiamata energia di risonanza del composto.
La spiegazione orbitale
Possiamo comprenderlo in termini di orbitali coinvolti.
Gli atomi di carbonio nel benzene sono #"sp"^2# ibridato e non ibridato #"p"_z# gli orbitali si sovrappongono lateralmente per formare le nuvole π della #"C=C"# doppi legami.
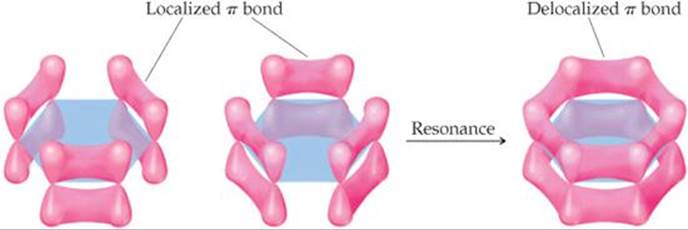
Tutti e sei #"p"# gli orbitali possono sovrapporsi lateralmente per formare una nuvola π "delocalizzata" di elettroni attorno all'anello.
Ogni volta che gli elettroni possono diffondersi o "delocalizzare", sono a livelli di energia più bassi.
La sovrapposizione può sembrare piccola nel diagramma sopra.

(Adattato dallo scambio di stack di fisica)
Tuttavia, l'immagine sopra disegnata dal computer lo dimostra #"2p"# gli orbitali sono in realtà molto più "grassi" delle forme allungate di lacrima che di solito disegniamo, e gli atomi di carbonio sono abbastanza vicini tra loro, quindi la sovrapposizione laterale degli orbitali è piuttosto significativa.

