Qual è l'ordine prioritario di fattori come risonanza, ibridazione, solvatazione, ecc. Nel determinare l'acidità relativa o la basicità dei composti in un elenco?
Risposta:
AVVERTIMENTO! Risposta lunga! Ecco i miei pensieri
Spiegazione:
Tutto ciò che diminuisce il #"X-H"# la forza di legame nell'acido o stabilizza la base del coniugato aumenterà l'acidità e diminuirà la basicità della base del coniugato.
Vorrei identificare i fattori nell'ordine 1. #bb"R"#esonance; 2. #bb"A"#tom; 3. #bb"D"#ipole #bb"I""#effetto nocivo; 4. #bb"O"#rbitals (#bb"RADIO"#).
Acidi forti
Esistono sei acidi forti comuni. In ordine di crescente acidità, sono:
#"HNO"_3 < "H"_2"SO"_4 < "HCl" < "HBr" < "HI" < "HClO"_4#
Qualsiasi acido forte è più forte della maggior parte degli acidi organici.
Alcuni fattori da considerare sono:
1. risonanza
Ho messo la stabilizzazione per risonanza dell'anione al primo posto nell'elenco.
Più contribuenti alla risonanza ha una base coniugata, più forte sarà l'acido.
Ciò spiega in parte perché l'acido solforico è più forte dell'acido nitrico.
Spiega anche perché l'acido acetico (#"p"K_"a" ≈5#) è un acido più forte di
etanolo (#"p"K_"a" ≈ 16#).
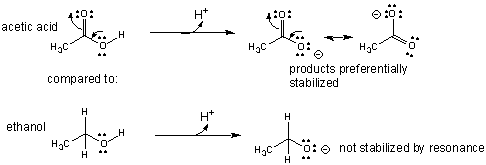
2. atomo
(A) L'acidità di HX aumenta da sinistra a destra la tavola periodica.
#color(white)(mmml)"CH"_4 < color(green)("N")"H"_3 < color(red)("H")_2"O" < "H"color(lime)("F")#
#"p"K_"a"color(white)(m)~50color(white)(mmll)38color(white)(mml)15.7color(white)(mm)3.2#
Come elettronegatività of #"X"# aumenta, il bonding gli elettroni vengono spinti più vicino #"X"# e l'acidità aumenta.
L'eccezione è #"HF"#, per cui la base coniugata #"F"^"-"# è stabilizzato mediante solvatazione da molecole d'acqua.
(B) L'acidità aumenta dall'alto verso il basso della tavola periodica.
#color(white)(mmml)"HF" < "HCl" < "HBr" < "HI"#
#"p"K_"a"color(white)(ml)3.8color(white)(mll)"-8.0"color(white)(mm)"-9.0"color(white)(mll)"-10"#
Mentre scendi in un gruppo, la lunghezza del legame diventa più lunga e più debole e la carica densità sullo ione diminuisce.
3. #bb"D"#ipoles e #bb"I"#Effetti negativi
Gli atomi elettronegativi attirano una carica negativa verso se stessi.
Ciò indebolisce il legame HX e stabilizza la base coniugata.
L'effetto diminuisce con la distanza dall'acido #"H"# atomo.

(Da SlidePlayer)
I gruppi alchilici sono gruppi che donano elettroni.
Spingono la densità dell'elettrone sul #"COOH"# raggruppare e destabilizzare lo ione carbossilato.
Più gruppi alchilici, più debole è l'acido.
4. Orbitali
Più #"s"# carattere in un orbitale, più gli elettroni saranno vicini al nucleo.
Come andiamo da #"sp"^3# (alcano) a #"sp"^2# (alchene) a #"sp"# (alkyne) ibridazione, aumenta la stabilità della carica negativa.
Gli alchini sono notevolmente acidi rispetto agli alcani.

Ecco un riassunto della discussione.

