Quale reazione ha luogo tra il cesio e l'acqua che lo fa reagire così violentemente?
Il cesio reagisce con acqua fredda per formare idrogeno gassoso e una soluzione di ioni di cesio e ioni idrossido.
2Cs (s) + 2H₂O (l) → H₂ (g) + 2Cs⁺ (aq) + 2OH⁻ (aq)
La reazione è così esplosiva che spesso frantuma il contenitore.
Possiamo scrivere le modifiche per l'atomo Cs come
(1) Cs (s) → Cs (g); #ΔH_"sub"# = +79 kJ / mol
(2) Cs (g) → Cs⁺ (g); #I_1# = +375.7 kJ / mol
(3) Cs⁺ (g) → Cs⁺ (aq); #ΔH_"hydr"# = -276 kJ / mol
L'energia di sublimazione (1) è il più piccolo dei metalli alcalini perché gli atomi Cs sono i più grandi.
Man mano che gli atomi si ingrandiscono, diminuiscono i punti di forza dei legami metallici. Ci vuole meno energia per portare gli atomi nella fase vapore.
L'energia di ionizzazione (2) è il più piccolo dei metalli alcalini.
Mentre scendete nel Gruppo, l'elettrone di valenza è più lontano dal nucleo ed è schermato da più strati di elettroni interni.
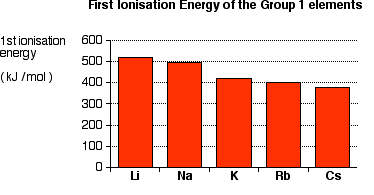
Le fasi di input di energia (1) e (2) sono correlate all'energia di attivazione della reazione. Quindi l'energia di attivazione per Cs è la più bassa, principalmente a causa della sua bassa energia di ionizzazione.
Più bassa è l'energia di attivazione, più veloce è la reazione. Quindi Cs reagisce in modo estremamente rapido e si ottiene un'esplosione.
Ecco un video che mostra la reazione di Cs con l'acqua.

