Quale dei seguenti composti può avere la massima energia reticolare?
Risposta:
(1) MgO ha la più alta energia reticolare.
Spiegazione:
L'energia reticolare dipende dall'attrazione tra gli ioni caricati in modo opposto.
La forza di attrazione #F# è direttamente proporzionale alle spese (#q_1# e #q_2#) sui due ioni e sulla distanza #r# fra loro.
#F = (q_1q_2)/r^2#
La distanza tra le accuse #r# è la somma dei raggi ionici.
#r = r_"anion" + r_"cation"#
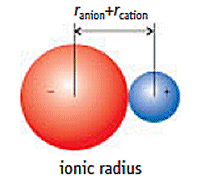
Quindi le maggiori attrazioni saranno tra gli ioni che hanno i raggi più piccoli.

E poiché l'attrazione dipende dal prodotto delle cariche, cerchiamo gli ioni con la massima carica.
Sia in CaO che in MgO, le cariche sono +2 e -2, quindi la scelta è tra questi due ossidi.
Gli ioni più piccoli saranno in grado di avvicinarsi l'uno all'altro.
Avranno la minima distanza tra i centri e avranno le più grandi energie reticolari.
Gli ioni più piccoli si trovano nella parte superiore del Periodic Table.
#"Mg"^(2+)# è più piccolo di #"Ca"^(2+)#, Così #"MgO"# ha la più grande energia reticolare.

