La teoria VBT prevede l'ibridazione O deriva l'ibridazione dalla teoria VSEPR VBT spiega il legame rispetto al VSEPR - non si aspettava che l'ibridazione H2O SP3 a causa di vespr non vbt si aspettasse in secondo luogo perché non esiste un'ibridazione in HF per la spiegazione VBT?
Risposta:
Ecco la mia risposta a quello che penso tu stia chiedendo.
Spiegazione:
Teoria del legame di valenza
Teoria di Valence Bond (VB) è basato su elettroni di valenza. Lo usiamo per aiutare a determinare la struttura di una molecola.
Iniziamo con la struttura di Lewis di una molecola e quindi spieghiamo la formazione di legami mediante la sovrapposizione di orbitali atomici.
Se il nostro uso di orbitali atomici semplici non spiega la forma osservata di una molecola, ricorrere quindi al concetto di orbitali atomici ibridati.
Teoria VB e #"HF"#
La struttura di Lewis di #"HF"# is

The configurazione elettronica of #"H"# is #"1s"#e la configurazione dell'elettrone di valenza di #"F"# is #"[He] 2s"^2"2p"_text(x)^2"2p"_text(y)^2"2p"_text(z)#.
Quindi, spieghiamo il #"H-F"# formazione di legami dalla sovrapposizione dell'idrogeno #"1s"# orbitale con il fluoro riempito per metà #"2p"# orbitale per formare un legame σ.
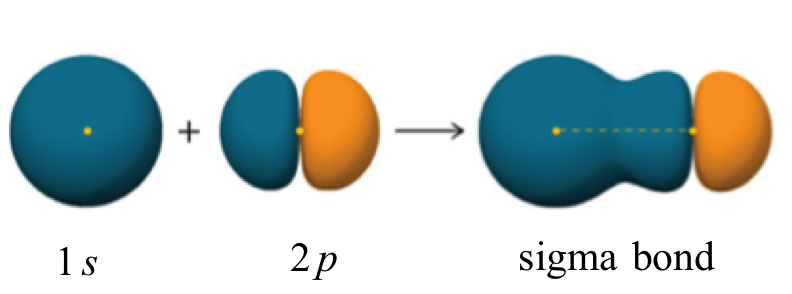
Poiché ci sono solo due atomi, la molecola è lineare e non dobbiamo usare l'ibridazione per spiegarne la forma.
Teoria VB e #"H"_2"O"#
La struttura di Lewis di #"H"_2"O"# is
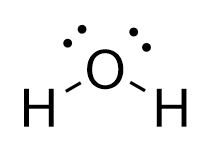
La configurazione dell'elettrone di valenza di #"O"# is #"[He] 2s"^2"2p"_text(x)^2"2p"_text(y)"2p"_text(z)#.
Quindi, potremmo spiegare il #"OH"# formazione di legami dalla sovrapposizione dell'idrogeno #"1s"# orbitale con l'ossigeno mezzo riempito #"2p"# orbitali per formare due legami σ.
Il problema è che questo prevede il #"H-O-H"# l'angolo di legame deve essere di 90 ° e l'angolo di legame osservato è di 104.5 °.
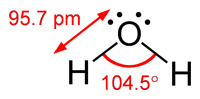
VSEPR teoria fornisce una migliore previsione dell'angolo di legame.
Le quattro coppie di elettroni si respingono ai quattro angoli di un tetraedro, per il quale l'angolo di legame teorico è di 109.5 °.
I quattro ibridati #"sp"^3# gli orbitali prevedono anche un angolo di legame di 109.5 °.
Spieghiamo la differenza di 5 ° dal teorico derivante dalla repulsione degli elettroni della coppia solitaria.


