Che tipo di forze intermolecolari sono presenti nei seguenti composti: C Cl_4 CCl4, CH_2Cl_2 CH2Cl2, CH_3OH CH3OH, CO_2 CO2, SCl_4 SCl4 e SCl_6 SCl6?
Attenzione! Risposta lunga. Ecco cosa ottengo.
Devi disegnare la struttura di Lewis di ogni molecola, usare la teoria VSEPR per determinarne la forma e quindi decidere se il legame dipoli Annulla.
"CO"_2CO2 e "CCl"_4CCl4

(Da www.peoi.org)
"CO"_2CO2 è una molecola lineare con un "O-C-O"O-C-O angolo di legame di 180 °. I dipoli di legame sono uguali e in direzioni opposte, quindi si annullano.
"CO"_2CO2 è una molecola non polare. Le sue forze intermolecolari più forti sono Forze di dispersione di Londra.
"CCl"_4CCl4 è una molecola tetraedrica con a "Cl-C-Cl"Cl-C-Cl angolo di incollaggio di 109.5 °.
Il due "C-Cl"C-Cl i dipoli di legame nel piano della carta hanno una risultante che punta verso destra con un angolo di 54.75 ° dalla verticale.
Il due "C-Cl"C-Cl i dipoli dietro e davanti al foglio hanno un risultato uguale e opposto al primo.
Poiché i dipoli obbligazionari sono uguali e in direzioni opposte, si annullano.
"CCl"_4CCl4 è una molecola non polare. Le sue forze intermolecolari più forti sono Forze di dispersione di Londra.
"CH"_2"Cl"_2CH2Cl2
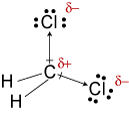
"CH"_2"Cl"_2CH2Cl2 ha una forma tetraedrica. Il due "C-Cl"C-Cl i dipoli obbligazionari hanno una risultante che taglia in due "Cl-C-Cl"Cl-C-Cl angolo di legame.
"CH"_2"Cl"_2CH2Cl2 è quindi una molecola polare, e le sue forze intermolecolari più forti sono forze dipolo-dipolo.
"CH"_3"OH"CH3OH
"CH"_3"OH"CH3OH ha un aspetto altamente polare "O-H"O-H legame. Il "O"O atomo ha un alto δ^"-" carica, e il "H" tutte lungo la "OH" ha un alto δ^+ carica.
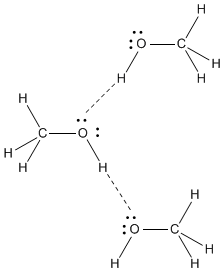
The "O" in una molecola è fortemente attratto da "H" in un'altra molecola, e il "H" in una molecola è fortemente attratto da "O" in un'altra molecola.
La più forte forza intermolecolare in "CH"_3"OH" is legame idrogeno.
"SCl"_4

(Da en.wikipedia.org)
"SCl"_4 ha una forma a sega.
I due orizzontali "S-Cl" i dipoli obbligazionari si annullano, ma i dipoli rivolti verso il basso si rafforzano a vicenda.
"SCl"_4 è una molecola polare, e le sue forze intermolecolari più forti sono forze dipolo-dipolo.
"SCl"_6
"SCl"_6è una molecola ottaedrica.
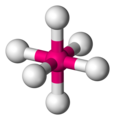
Ogni "S-Cl" il dipolo di legame ha un partner che punta esattamente nella direzione opposta, quindi tutti i dipoli di legame si annullano.
"SCl"_6 è una molecola non polare, quindi sono le sue forze intermolecolari più forti Forze di dispersione di Londra.

