Come posso calcolare l'ordine delle obbligazioni del benzene?
Disegna gli orbitali molecolari. Quindi aggiungi gli elettroni e conti il numero di bonding e elettroni anti-condensa.
L'ordine di legame di un legame è la metà della differenza tra il numero di elettroni di legame e di anti-condensa.
BO = ½ (B - A)
Le obbligazioni CC σ
Ogni legame CC σ è un legame localizzato. Ha 2 elettroni di legame e 0 elettroni non di legame.
σ BO = ½ (B - A) = ½ (2 - 0) = 1
Le obbligazioni CC π
Il benzene ha 6 orbitali molecolari π.
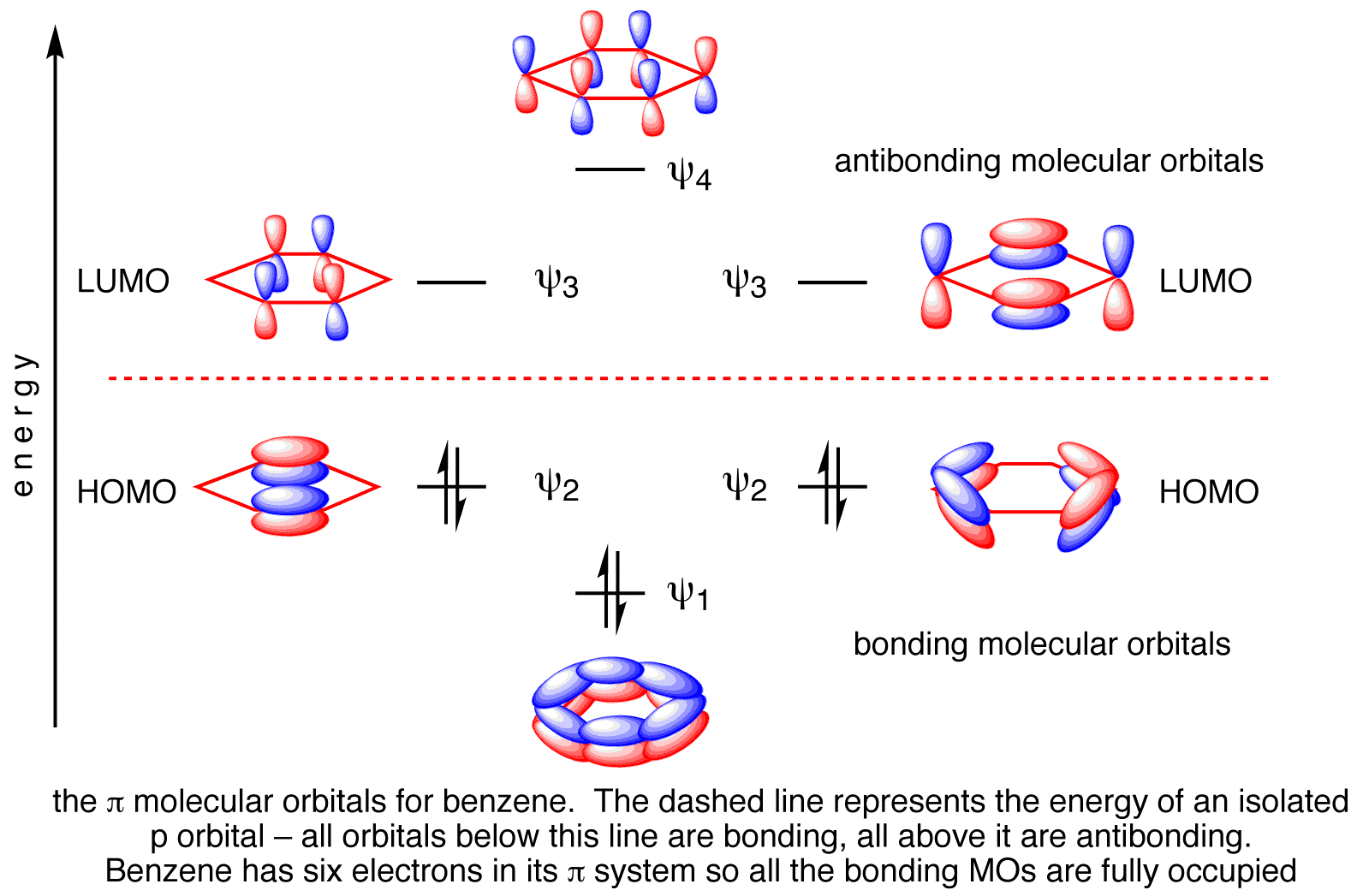
Di questi, tre sono legati e tre sono anti-condensa. I sei elettroni π entrano nei tre orbitali di legame.
π BO = ½ (B - A) = ½ (6 - 0) = 3
Questo è l'ordine delle obbligazioni π per 6 obbligazioni CC.
Per un legame CC π, BO = 3/6 = 0.5.
Per un singolo legame CC nel benzene, il totale BO = σ + π = 1 + 0.5 = 1.5.

