Come posso determinare la forma molecolare di una molecola?
Risposta:
AVVERTIMENTO. Questo è un documento LUNGO. Copre tutte le forme possibili per molecole con un massimo di sei coppie di elettroni attorno all'atomo centrale.
Spiegazione:
PASSAGGI COINVOLTI
Esistono tre passaggi di base per determinare la forma molecolare di una molecola:
-
Scrivi la struttura a punti di Lewis della molecola. Questo ti dà il numero sterico (SN) - il numero di coppie di legame e coppie solitarie attorno all'atomo centrale.
-
Utilizzare SN e VSEPR teoria per determinare la geometria della coppia di elettroni della molecola.
-
Utilizzare la forma VSEPR per determinare gli angoli tra bonding coppie.
PRINCIPI VSEPR:
-
La repulsione tra coppie di elettroni di valenza nel guscio esterno dell'atomo centrale determina la forma della molecola. È necessario determinare il numero sterico (SN) - il numero di coppie di legame e coppie solitarie intorno all'atomo centrale.
-
Le coppie solitarie respingono più delle coppie di bond bonding.
A. SN = 2
Qual è la forma di #"BeCl"_2#?
La struttura a punti di Lewis per #"BeCl"_2# is

Il centro #"Be"# atomo ha due coppie di legami nel suo guscio esterno (SN = 2).
La repulsione tra queste due coppie fa sì che gli atomi siano il più distanti possibile.
La forma della molecola è lineare e la #"Cl-Be-Cl"# l'angolo di legame è di 180 °.
B. SN = 3
Vi sono due possibilità.
i. #"AX"_3# - Tre coppie di legame
Qual è la forma di #"BF"_3#?
La struttura a punti di Lewis #"BF"_3# is

The #"B"# atomo ha tre coppie di legami nel suo guscio esterno.
Ridurre al minimo la repulsione provoca il #"F"# atomi per formare un triangolo equilatero attorno al #"B"# atomo, come mostrato di seguito.

La forma della molecola è trigonale planare.
Tutti gli atomi sono sullo stesso piano e il #"F-B-F"# gli angoli di legame sono tutti di 120 °.
ii. #"AX"_2"E"# - due coppie di legami e una coppia solitaria
Qual è la forma di #"SO"_2#?
La struttura a punti di Lewis #"SO"_2# is

L'atomo centrale, #"S"#, ha tre gruppi legati ad esso, due atomi di ossigeno e una coppia solitaria.
La geometria della coppia di elettroni di #"SO"_2# è planare trigonale.
Sarebbe disegnato come

La forma molecolare di #"SO"_2# non è trigonale planare.
Nel determinare la forma molecolare, consideriamo solo le posizioni degli atomi, non le coppie solitarie.
Quindi, la forma molecolare di #"SO"_2# è piegato ed è rappresentato come

La sola coppia di elettroni occupa un volume relativamente grande, poiché sono trattenuti da un solo atomo.
Comprimono l'angolo di legame tra gli ossigeni e lo zolfo a circa 119.5 °.
C. SN = 4
Vi sono quattro possibilità.
i. #"AX"_4# - quattro coppie di legame
Qual è la forma di #"CH"_4#?
La struttura a punti di Lewis #"CH"_4# is

La forma di questa molecola, tuttavia, non è planare, come si potrebbe pensare dal modo in cui disegniamo questa struttura a punti.
Le quattro coppie di legami sono disposte attorno al #"C"# atomo, che punta verso gli angoli di un normale tetraedro.
Questa forma minimizza la repulsione tra le coppie di legame.

L'angolo di 109.5 ° è uguale per tutti #"H-C-H"# angoli di legame ed è chiamato angolo di legame tetraedrico.
La forma del #"CH"_4# la molecola è tetraedrica.
ii. #"AX"_3"E"# - tre coppie di legami e una coppia solitaria.
Qual è la geometria molecolare of #"NH"_3#?
La struttura a punti di Lewis di #"NH"_3# is

L'atomo centrale, #"N"#, ha quattro gruppi legati ad esso: tre atomi di idrogeno e una coppia solitaria.
La geometria della coppia di elettroni di #"NH"_3# è tetraedrico.
È disegnato come mostrato di seguito:

Ricorda che, nel determinare la forma molecolare, consideriamo solo le posizioni degli atomi, non le coppie solitarie.
Se guardiamo solo gli atomi, vediamo un tetraedro corto, piuttosto distorto.
Questa si chiama piramide.
The #"NH"_3# la piramide ha una base triangolare.
Quindi la forma è piramidale trigonale.
La maggiore repulsione della coppia solitaria provoca il #"H"# atomi in #"NH"_3# essere piegato più vicino rispetto al normale angolo tetraedrico di 109.5 °.
In #"NH"_3# l'osservato #"H-N-H"# l'angolo di legame è di 107.3 °.
iii. #"AX"_2"E"_2# - due coppie di legami e due coppie solitarie
Qual è la geometria molecolare di #"H"_2"O"#?
La struttura a punti di Lewis di #"H"_2"O"# is

L'atomo centrale, #"O"#, ha quattro gruppi legati ad esso, due atomi di idrogeno e due coppie solitarie.
La geometria della coppia di elettroni di #"H"_2"O"# è tetraedrico.
È disegnato come mostrato di seguito:

La forma si chiama piegata.
The #"H-O-H"# l'angolo di legame è inferiore a quello in #"NH"_3#, in parte a causa delle maggiori repulsioni causate da due coppie solitarie.
In acqua, l'osservato #"H-O-H"# l'angolo di legame è di 104.5 °.
Tutti gli angoli di legame dentro #"AX"_2"E"_2# le molecole sono significativamente inferiori a 109.5 °.
D. SN = 5
Vi sono quattro possibilità.
i. #"AX"_5# - cinque coppie di obbligazioni
Qual è la forma molecolare di #"PCl"_5#?
La struttura a punti di Lewis di #"PCl"_5# is

Atomi passati #"Si"# in la tavola periodica possono "espandere il loro ottetto" e avere più di otto elettroni di valenza.
Qui, il #"P"# atom ne ha dieci elettroni di valenza.
Se visualizzi il file #"P"# atomo al centro di una sfera come la terra, ne hai una #"Cl"# atomo al Polo Nord, uno #"Cl"# atomo al Polo Sud e tre #"Cl"# gli atomi si diffondono uniformemente attorno all'equatore.

Notare quello #"Cl"# gli atomi occupano due tipi di posizioni.
Il due #"Cl"# atomi che si trovano su una linea retta che passa attraverso il #"P"# si dice che il nucleo occupi posizioni assiali.
Le altre tre #"Cl"# gli atomi sono in posizioni equatoriali.
Se ti unisci al #"Cl"# atomi con linee rette, il diagramma appare come due piramidi trigonali unite alla base.
The #"PCl"_5# la molecola ha una forma bipiramidale trigonale.
Esistono due diversi angoli di legame nella molecola.
L'assiale #"Cl"# gli atomi sono ad angoli di 90 ° rispetto all'equatore #"Cl"# atomi, mentre l'equatoriale #"Cl"# gli atomi sono ad angoli di 120 ° l'uno rispetto all'altro.
ii. #"AX"_4"E"# - Quattro coppie di legami e una coppia solitaria.
Qual è la forma molecolare di #"SF"_4#?
La struttura a punti di Lewis di #"SF"_4# is

Le cinque coppie di elettroni assumono una geometria bipiramidale trigonale.

La coppia solitaria occupa una posizione equatoriale, perché la allontana più lontano dalle altre coppie di elettroni.
Se si gira la molecola su un lato, sembra una sega, con l'assiale #"F"# atomi alle estremità ed equatoriale #"F"# atomi che agiscono come perno.
La forma si chiama sega.

L'assiale #"F–S–F"# l'angolo di legame è di 173.1 ° anziché 180 °, a causa della sola coppia di elettroni nel piano equatoriale.
L'equatoriale #"F-S-F"# l'angolo di legame è compresso a 101.6 ° dal suo valore normale di 120 °.
iii. #"AX"_3"E"_2# - coppie di legami tra alberi e due coppie solitarie
Qual è la forma molecolare di #"ClF"_3#?
La struttura a punti di Lewis di #"ClF"_3# is
https://s3.amazonaws.com/classconnection/153/flashcards/919153/png/download_(3) -1518046CE7937FB18BB.png
Le cinque coppie di elettroni assumono una geometria bipiramidale trigonale.

Le due coppie solitarie occupano le posizioni equatoriali al fine di minimizzare le repulsioni.
Le coppie di legame formano una forma a T, e questa è la forma della molecola.

In realtà, la molecola ha una forma a "T distorta" perché le due coppie solitarie riducono la #"F-S-F"# angolo di legame da 90 ° a 86.98 ° e il #"F-S-F"# l'angolo di legame attraverso la parte superiore della T è ridotto da 180 ° a 173.96 °.
iv. #"AX"_2"E"_3# - due coppie di legame e tre coppie solitarie
Qual è la forma molecolare di #"XeF"_2#?
La struttura a punti di Lewis di #"XeF"_2# is

Le cinque coppie di elettroni assumono una geometria bipiramidale trigonale.
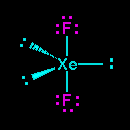
Le tre coppie solitarie occupano le tre posizioni equatoriali, quindi quello che hai è un atomo di xeno con tre coppie solitarie che puntano verso gli angoli di un triangolo equilatero, con una #"F"# atomo sotto il triangolo e un altro sopra.
Il risultato è una forma lineare per #"XeF"_2# molecola e il #"F-Xe-F"# l'angolo di legame è di 180 °.
E. SN = 6
Vi sono cinque possibilità.
i. #"AX"_6# - sei coppie di legame
Qual è la forma molecolare di #"SF"_6#?
La struttura a punti di Lewis di #"SF"_6# is

Le sei coppie di legame si organizzano con quattro coppie di legame equatoriali e un'altra coppia in ciascuna delle posizioni polari.

La forma si chiama ottaedro.
Ogni #"F-S-F"# l'angolo di legame è di 90 °.
ii. #"AX"_5"E"# - cinque coppie di legame e una coppia solitaria
Qual è la struttura di #"IF"_5#?
La struttura a punti di Lewis di #"IF"_5# is
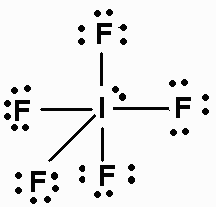
Le coppie di elettroni si dispongono agli angoli di un ottaedro con una coppia solitaria che occupa una di queste posizioni.
Quattro dei #"F"# gli atomi sono agli angoli di un quadrato e uno è direttamente sopra #"I"# atomo.
Linee che collegano il #"F"# gli atomi formano una piramide a base quadrata, quindi la forma è piramidale quadrata.
The #"F-I-F"# angoli tra vicini #"F"# gli atomi sono 90 °.
iii. #"AX"_4"E"_2# - quattro coppie di legami e due coppie solitarie
Qual è la forma molecolare di #"XeF"_4#?
La struttura del punto di Lewis è

Le coppie di elettroni si dispongono agli angoli di un ottaedro.
Le quattro coppie di legame puntano verso gli angoli di un quadrato e le coppie solitarie occupano le posizioni assiali sopra e sotto il piano del quadrato.

Dal momento che i quattro #"F"# gli atomi sono agli angoli di un quadrato, la forma molecolare è quadrata planare.
The #"F-Xe-F"# angoli di legame tra vicini #"F"# gli atomi sono 90 °.
iv. #"AX"_3"E"_3# - tre coppie di legame e tre coppie solitarie
Non ci sono molecole che appartengono al #"AX"_3"E"_3# sistema.
Tuttavia, la geometria elettronica è ottaedrica, con le tre coppie solitarie che occupano posizioni equatoriali.
Le restanti coppie di legame sono disposte a forma di T con angoli di legame di 90 °.
![]()
v. #"AX"_2"E"_4# - due coppie di legame e quattro coppie solitarie
Non stabile #"AX"_2"E"_4# le molecole sono note.
Tuttavia, prevediamo che la forma molecolare sia lineare con angoli di legame di 180 °.
![]()
SOMMARIO
Per prevedere la forma di una molecola:
-
Scrivi la struttura del punto di Lewis per la molecola.
-
Determina il numero sterico dell'atomo centrale.
-
Decidi l'orientamento della coppia di elettroni in base al numero sterico.
-
Considera il posizionamento di coppie solitarie e qualsiasi distorsione da forme "regolari".
-
Denominare la forma in base alla posizione degli atomi attaccati all'atomo centrale
La tabella seguente riassume tutte le forme molecolari.



