Cosa sono gli orbitali s, p, d, f?
Risposta:
Gli orbitali sono le regioni dello spazio in cui è più probabile trovare gli elettroni.
Spiegazione:
Ogni orbitale è indicato da un numero e una lettera.
Il numero indica il livello di energia dell'elettrone nell'orbitale. Quindi 1 si riferisce al livello di energia più vicino al nucleo; 2 si riferisce al successivo livello di energia più avanti, e così via.
La lettera si riferisce alla forma dell'orbitale. Le lettere vanno nell'ordine s, p, d, f, g, h, i, j, ecc. Le lettere s, p, d e f sono state assegnate per ragioni storiche che non devono riguardarci. Tutto ciò che dobbiamo fare è ricordare le forme che corrispondono a ciascuna lettera.
Poiché un elettrone può teoricamente occupare tutto lo spazio, è impossibile disegnare un orbitale. Tutto ciò che possiamo fare è disegnare una forma che includa l'elettrone il più delle volte, diciamo il 95% delle volte. Chiamiamo questa forma il contorno del 95%.
s ORBITALI
Un orbitale è sfericamente simmetrico attorno al nucleo dell'atomo, come una palla cava fatta di materiale piuttosto soffice con il nucleo al centro. Quando i livelli di energia aumentano, gli elettroni si trovano più lontano dal nucleo, quindi gli orbitali diventano più grandi. L'ordine delle dimensioni è 1s <2s <3s <…, come mostrato di seguito.
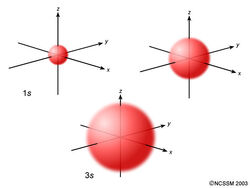
Ora diamo un'occhiata a una sezione trasversale di questi orbitali.

Se osservi attentamente, noterai che un orbitale 1s ha pochissimo elettrone densità vicino al nucleo, ma si accumula al massimo man mano che ci si allontana dal nucleo e quindi diminuisce oltre il contorno. È un po 'come una pallina da tennis vuota.
Un orbitale 2s è simile all'orbitale 1s, ma ha una sfera di densità elettronica all'interno della sfera esterna, come una palla da tennis all'interno di un'altra. C'è una superficie tra le due sfere in cui non vi è alcuna probabilità di trovare un elettrone. Chiamiamo questa superficie un nodo o una superficie nodale.
Un orbitale 3s è ancora più grande e ha tre nodi.
p ORBITALI
Non tutti gli elettroni abitano negli orbitali. Al primo livello di energia, l'unico orbitale disponibile per gli elettroni è l'orbitale 1s. Tuttavia, al secondo livello, ci sono anche orbitali chiamati orbitali 2p oltre all'orbitale 2s.
A differenza di un orbitale, l'orbitale punta in una direzione particolare. Quello mostrato sotto punta su e giù nella pagina.

Ad ogni livello di energia, abbiamo tre orbitali p assolutamente equivalenti che si puntano reciprocamente ad angolo retto. Questi sono arbitrariamente dati i simboli px, py e pz. Questo è semplicemente per comodità, perché ciò che potresti pensare come la direzione x, y o z cambia costantemente mentre l'atomo cade nello spazio.
Gli orbitali p al secondo livello di energia sono chiamati 2px, 2py e 2pz. Esistono orbitali simili ai livelli successivi: 3px, 3py, 3pz, 4px, 4py, 4pz e così via.
Tutti i livelli tranne il primo hanno orbitali p.

d ORBITALI
Oltre agli orbitali s e p, ci sono altre due serie di orbitali che diventano disponibili per gli elettroni che abitano a livelli di energia più elevati. Al terzo livello, vi è un insieme di cinque orbitali d (con forme e nomi complicati) oltre agli orbitali 3s e 3p (3px, 3py, 3pz). Al terzo livello ci sono complessivamente nove orbitali.
Vengono chiamati i cinque orbitali 3d
3dxy
3dxz
3dyz
3dx² - y²
3dz²

Per dare un senso ai nomi, dobbiamo esaminarli in due gruppi. Il primo gruppo contiene gli orbitali 3dxy, 3dxz e 3dyz. I nomi indicano che questi orbitali si trovano rispettivamente nel piano xy, nel piano xz e nel piano yz. Ogni orbitale ha quattro lobi e ciascuno dei lobi punta tra due assi, non lungo di essi.
Il secondo gruppo contiene gli orbitali 3dx² - y² e 3dz². I loro lobi puntano lungo i vari assi.
L'orbitale 3dx² - y² assomiglia esattamente al primo gruppo, tranne per il fatto che i lobi puntano lungo gli assi xey, non tra di loro.
Il 3dz² sembra un orbitale ap che indossa una ciambella intorno alla vita.
f ORBITALI
Al quarto e superiore livello, ci sono sette orbitali f oltre agli orbitali 4s, 4p e 4d.
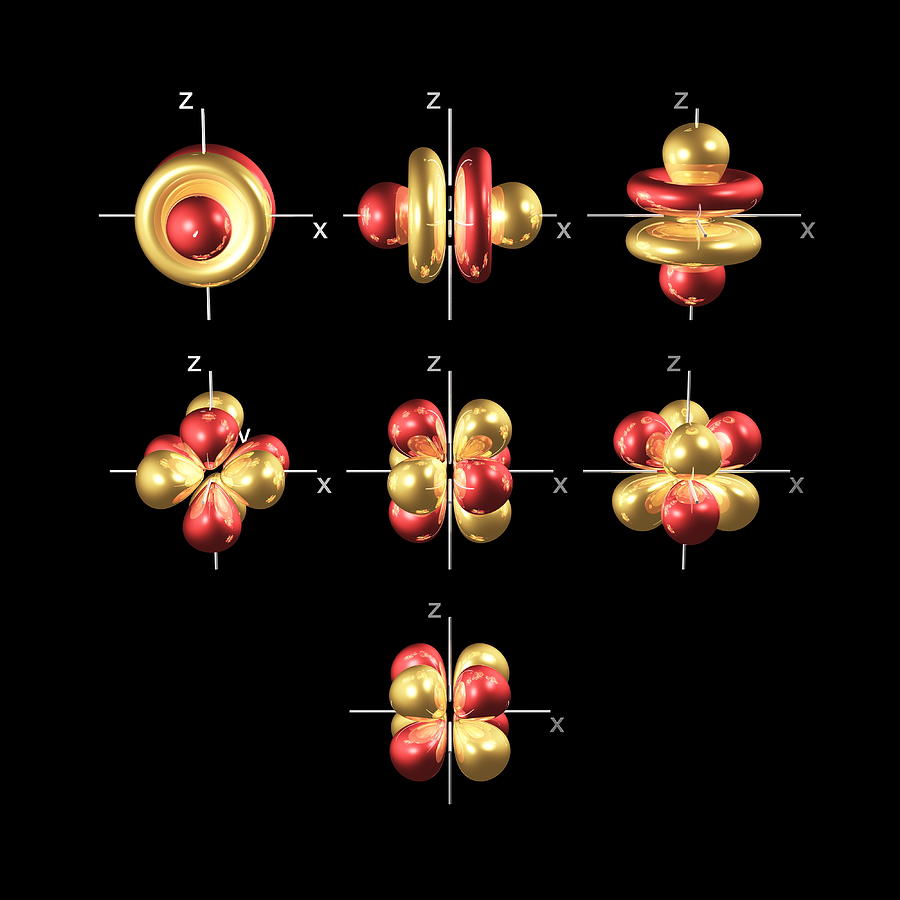
Contando gli orbitali 4s, 4p e 4d, si ottiene un totale di 16 orbitali nel quarto livello. Hanno forme ancora più complicate. Gli orbitali s, p, d e f sono disponibili anche a tutti i livelli di energia più elevati. Fortunatamente, probabilmente non dovrai memorizzare le forme degli orbitali. Basta ricordare che ci sono sette orbitali f in ogni livello dal livello 4 in poi.

