Cos'è una soluzione supersaturata?
A soluzione supersaturata ne contiene di più soluto a una data temperatura di quanto è necessario per formare una soluzione satura.
L'aumento della temperatura solitamente aumenta la solubilità dei solidi nei liquidi.
Ad esempio, la solubilità del glucosio a 25 ° C è 91 g / 100 mL di acqua. La solubilità a 50 ° C è di 244 g / 100 mL di acqua.
Se aggiungiamo 100 g di glucosio a 100 ml di acqua a 25 ° C, 91 g si dissolvono. Sul fondo rimangono nove grammi di solido. Abbiamo una soluzione satura.
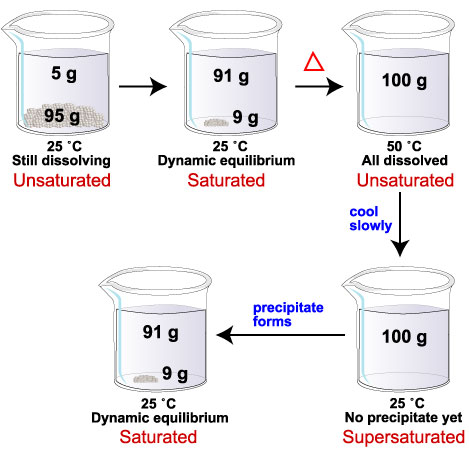
Se ora riscaldiamo la miscela a 50 ° C, i rimanenti 9 g di glucosio si dissolveranno. Alla nuova temperatura, il limite di solubilità in 100 mL di acqua è di 244 g di glucosio. Con solo 100 g di glucosio sciolto, la soluzione è ora insatura.
Se raffreddiamo nuovamente la miscela a 25 ° C, 9 g di glucosio dovrebbero precipitare dalla soluzione.
Se i cristalli di glucosio non si formano, il sistema ha più glucosio disciolto (100 g) di quanto possa trattenere a 25 ° C (91 g). Abbiamo una soluzione super saturata.
Il primo passo nella formazione dei cristalli è nucleazione. Questo è quando le molecole di soluto si organizzano per formare cristalli.
A volte questo accade in una volta. In caso contrario, abbiamo una soluzione super saturata. Questa è una situazione instabile.
Un pezzo di polvere o un piccolo cristallo del soluto, un cristallo di seme, fornisce una sagoma per la cristallizzazione del soluto in eccesso. Il soluto in eccesso inizia a formare cristalli sui nuclei.
Una volta che i cristalli iniziano a formarsi, la loro superficie aumenta man mano che crescono. Ciò attira più molecole e promuove la crescita a un ritmo sempre crescente. Infine, la soluzione si stabilizza e non si formano più cristalli.

