Quali sono le reazioni per ammine e ammidi?
Un'ammina è un composto organico, correlato all'ammoniaca, che contiene un atomo di azoto legato a uno o più gruppi alchilici su ciascuna molecola

#"Primary amine"#

#"an example of Secondary amine"#

#"Tertiary amine"#

Gli atomi di azoto che fanno parte di un anello aromatico hanno una configurazione planare (configurazione sp2) e non centri stereogenici. A causa dell'aromacità le ammine negli anelli aromatici sono stabili.
Come l'ibridazione dell'azoto ha effetti sulla sua potenza di acido e base.
Il carattere più elevato dell'azoto rende il composto acido, ad esempio in piridina e nitrili.
In secondo luogo, l'anilina e la p-nitroanilina sono basi più deboli a causa della delocalizzazione della coppia di elettroni non leganti azoto nell'anello aromatico (e il sostituente nitro). Questa è la stessa delocalizzazione che provoca l'attivazione di un anello benzenico verso la sostituzione elettrofila.
Le seguenti equazioni di risonanza, simili a quelle utilizzate per spiegare la maggiore acidità dell'orto e dei para-nitrofenoli, illustrano la delocalizzazione di coppie di elettroni nella p-nitroanilina.
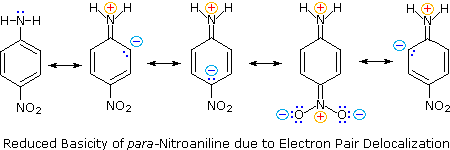
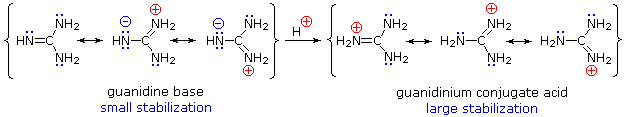
Sebbene la delocalizzazione della risonanza generalmente riduca la basicità delle ammine, un esempio drammatico dell'effetto inverso si trova nella guanidina composta (pKa = 13.6).
Le ammine sono per lo più basiche ma alcune hanno ridotto la basicità per questi motivi
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Quando reagite con acidi, le ammine donano elettroni per formare sali di ammonio.

Gli alogenuri acidi reagiscono con le ammine per formare ammidi sostituite

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Produzione di basi Schiff da ammine primarie
Aldeidi e chetoni reagiscono con le ammine primarie per dare un prodotto di reazione (una carbinolamina) che si disidrata per produrre aldimine e chetamine (basi di Schiff)

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Se reagisci alle ammine secondarie con aldeidi o chetoni, si formano gli smalti.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Le ammine reagiscono con i solfonil cloruri per produrre sulfamidici. Un esempio tipico è la reazione del benzene solfonil cloruro con anilina.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Il test di Hinsberg
Il test di Hinsberg, in grado di distinguere le ammine primarie, secondarie e terziarie, si basa sulla formazione di solfonamide. Nel test di Hinsberg, un'ammina viene fatta reagire con benzene solfonil cloruro. Se si forma un prodotto, l'ammina è un'ammina primaria o secondaria, poiché le ammine terziarie non formano solfonammidi stabili. Se la solfonamide che si forma si dissolve in una soluzione acquosa di idrossido di sodio, si tratta di un'ammina primaria. Se la solfonamide è insolubile in idrossido di sodio acquoso, è un'ammina secondaria. La solfonamide di un'ammina primaria è solubile in una base acquosa perché possiede ancora un idrogeno acido sull'azoto, che può essere perso per formare un sale di sodio.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Ossidazione di ammine
Sebbene sia possibile ossidare tutte le ammine, solo le ammine terziarie forniscono prodotti facilmente isolati. L'ossidazione di un'ammina terziaria porta alla formazione di un ossido di ammina.

Le arilamine tendono ad essere facilmente ossidate, con ossidazione che si verifica sia nel gruppo amminico che nell'anello.
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Reazione con acido nitroso
L'acido nitroso è instabile e deve essere preparato nella soluzione di reazione mescolando nitrito di sodio con acido.
Le ammine primarie reagiscono con l'acido nitroso per produrre un sale di diazonio, che è altamente instabile e degrada in un carbocatione che è in grado di reagire con qualsiasi nucleofilo in soluzione. Pertanto, la reazione delle ammine primarie con acido nitroso porta a una miscela di alcol, alcheni e alogenuri alchilici.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Le ammine aromatiche primarie formano sali di diazonio stabili a zero gradi.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Le ammine alifatiche e aromatiche secondarie formano nitrosoamina con acido nitroso.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Le ammine terziarie reagiscono con l'acido nitroso per formare composti di N-nitrosoammonio.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Reazioni di sali aromatici di diazonio
I sali di diazonio delle ammine aromatiche sono molto utili come intermedi ad altri composti. Poiché i sali di diazonio aromatici sono stabili solo a temperature molto basse (zero gradi e inferiori), il riscaldamento di questi sali avvia la decomposizione in cationi altamente reattivi. Questi cationi possono reagire con qualsiasi anione presente in soluzione per formare una varietà di composti. La figura seguente illustra la diversità delle reazioni.

Scriverò delle ammidi in un'altra risposta a questa domanda

