Tutte le seguenti molecole contengono almeno un angolo di legame a 120 gradi: SeS3, SeS2, PCl5, TeCl4, ICI3 e XeCl2?
Risposta:
No, perché due delle molecole non hanno angoli di legame a 120 °.
Spiegazione:
Per rispondere a questa domanda, è necessario disegnare le strutture di Lewis dei composti e determinarne le forme VSEPR.
#"SeS"_3#
La struttura di Lewis di #"SeS"_3# is

(Da www.homeworklib.com)
Questo è uno #"AX"_3# molecola e la sua geometria è trigonale planare.
Tutti gli angoli di legame in una molecola planare trigonale sono di circa 120 °.
#"SeS"_2#
La struttura di Lewis di #"SeS"_2# is
#:stackrel(". .")("S")=stackrel(". .")("Se")=stackrel(". .")("S"):#
Questo è uno #"AX"_2"E"# molecola.
La sua geometria elettronica è trigonale planare.
L'angolo di legame in un #"AX"_2"E"# la molecola è di circa 120 °.
#"PCl"_5#
La struttura di Lewis di #"PCl"_5# is
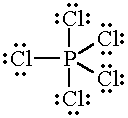
Questo è uno #"AX"_5# molecola e la sua geometria è piramidale trigonale.
Gli angoli di legame equatoriale in una molecola bipiramidale trigonale sono tutti 120 °.
#"TeCl"_4#
La struttura di Lewis di #"TeCl"_4# is

Questo è uno #"AX"_4"E"# molecola.
La sua geometria elettronica è piramidale trigonale.
L'angolo di legame equatoriale tra l'equatore #"Te-Cl"# le obbligazioni sono di circa 120 °.
#"ICl"_3#
La struttura di Lewis di #"ICl"_3# is
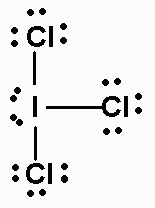
Questo è uno #"AX"_3"E"_2# molecola.
La sua geometria elettronica è piramidale trigonale e la sua geometria molecolare è a forma di T.
The #"I-Cl"# gli angoli di legame in una molecola a forma di T sono entrambi di circa 90 °.
#"XeCl"_2#
La struttura di Lewis di #"XeCl"_2# is
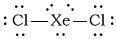
Questo è uno #"AX"_2"E"_3# molecola.
La sua geometria elettronica è piramidale trigonale, con le coppie solitarie nelle posizioni equatoriali.
La molecola è lineare, con a #"Cl-Xe-Cl"# angolo di legame di 180 °.

