Come posso riempire gli orbitali di legame e anti-condensa?
Una volta disegnati ed etichettati gli orbitali molecolari, li riempi nello stesso ordine in cui riempi gli orbitali atomici.
Le regole che usi per riempire gli orbitali atomici sono:
1. Principio di Aufbau
Metti gli elettroni negli orbitali di energia più bassi disponibili.
2. Principio di esclusione di Pauli
Nessun orbitale può contenere più di due elettroni e devono avere spin opposti.
3. Regola di Hund
Ogni orbitale in una subshell deve contenere solo un elettrone prima che qualsiasi orbitale possa avere due elettroni. Tutti gli elettroni negli orbitali occupati singolarmente devono avere lo stesso spin.
Usa le stesse regole per riempire gli orbitali molecolari.
Appliciamo questo al diagramma orbitale molecolare dell'ossigeno.
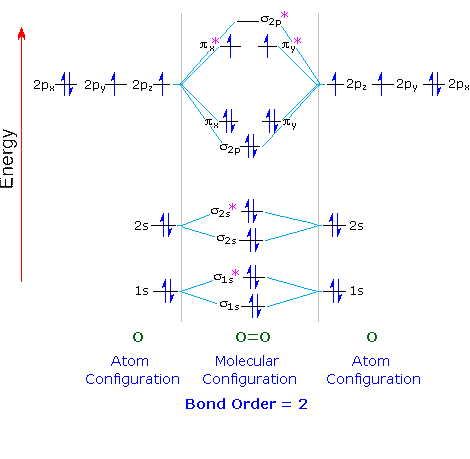
Ogni atomo O contiene 8 elettroni, quindi abbiamo 16 elettroni da mettere negli orbitali molecolari di O₂.
Mettiamo due elettroni in ciascuno degli σ1, σ1, σ2s, σ2se σ2p (10 elettroni).
I successivi quattro elettroni seguono la Regola di Hund e procedono nell'ordine #π_x#, #π_y#, #π_x# e #π_y# orbitali.
I restanti due elettroni seguono la Regola di Hund e procedono nell'ordine #π_x^"*"# e #π_y^"*"# orbitali.
Una molecola di ossigeno ha due elettroni spaiati.

