Qual è la struttura di Lewis per # SO_2 #?
Risposta:
Ecco i passaggi che seguo quando disegno una struttura di Lewis.
Spiegazione:
1. Decidi qual è l'atomo centrale nella struttura. Quello sarà normalmente l'atomo meno elettronegativo (#"S"#).
2. Disegna una struttura scheletrica in cui gli altri atomi sono legati in modo singolo all'atomo centrale: #"O-S-O"#.
3. Disegna una struttura di prova mettendo coppie di elettroni attorno ad ogni atomo fino a quando ognuno non ottiene un ottetto. In questo editor, dovrò scriverlo come :: Ö-S (::) - Ö ::
4. Conta il elettroni di valenza nella struttura di prova (20).
5. Ora conta il elettroni di valenza hai effettivamente disponibile. #"1 S + 2 O = 1×6 + 2×6 = 18"#. La struttura di prova ha due elettroni extra.
6. Disegna una nuova struttura di prova, questa volta inserendo un doppio legame per ogni coppia di elettroni extra:
#"O=S-O"# e #"O-S=O"#
7. Come prima, aggiungi elettroni di valenza per dare ad ogni atomo un ottetto:

8. Calcola la carica formale su ciascun atomo.
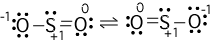
9. Vediamo che alcuni degli atomi hanno accuse formali. La "migliore" struttura di Lewis è quella in cui ha il minor numero di accuse formali. Possiamo generare una struttura con zero cariche formali se spostiamo una coppia solitaria dal legame singolo #"O"# fare un doppio legame con il #"S"#.
Questo ci dà una terza possibilità:

Ora abbiamo una struttura in cui #"S"# ha dieci elettroni di valenza. Tuttavia, va bene, perché #"S"# può "espandere" il suo ottetto.
Abbiamo tre diverse strutture, che differiscono SOLO nelle posizioni degli elettroni. Diciamo che questi sono strutture di risonanza of #"SO"_2#.
L'attuale struttura di #"SO"_2# è un ibrido di risonanza di tutte e tre le strutture.

