Quali basi coniugate deprotoneranno l'acqua?
Risposta:
La base coniugata di qualsiasi acido con a pK_"a"pKa maggiore dell'acqua deprotonerà l'acqua.
Spiegazione:
Ecco un breve pK_"a"pKa tabella.
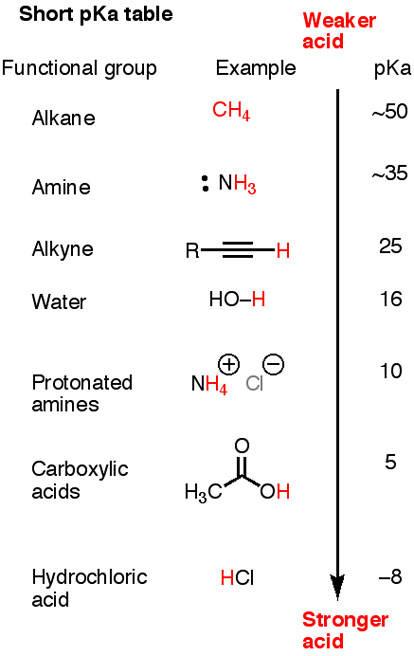
Si noti che "HC≡C-H", "H"_2"N-H"HC≡C-H,H2N-H e "H"_3"C-H"H3C-H sono tutti acidi più deboli dell'acqua.
Le basi coniugate corrispondenti, "H-C≡C:"^"-", "H"_2"N:"^"-"H-C≡C:-,H2N:- e "H"_3"C:"^"-"H3C:-, Sono forte. Tutti deprotoneranno l'acqua.
La base coniugata di metano "H"_3"C:"^"-"H3C:- è abbastanza forte da deprotonare qualsiasi cosa al di sotto di esso nella tabella.
metillitio, "CH"_3"Li"CH3Li, è una delle basi più forti in circolazione.
Ione acetilide ("H-C≡C:"^"-"H-C≡C:-) è abbastanza forte da deprotonare solo un acido con a "pK"_"a" < 25pKa<25.
Ione acetato ("CH"_3"COO"^"-"CH3COO-) è ancora più debole, in grado di deprotonare solo un acido con a pK_a < 5pKa<5.
Una tabella più completa di pK_"a"pKa i valori ti daranno molte più basi coniugate che deprotoneranno l'acqua.

